研究内容Research

触媒的不斉合成反応
光学活性シッフ塩基―金属触媒を用いた種々の触媒的不斉合成反応
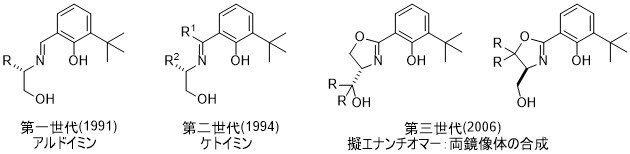
1.1 ONO型三座配位子の開発
私たちは1991年にキラルシッフ塩基配位子とチタンアルコキシドとからなる触媒を用いて、初めての触媒的不斉シリルシアノ化反応を達成しました。1この触媒系はジケテンのアルデヒドへの不斉付加反応においても有効でした。2この反応で得られる光学活性5-ヒドロキシ-3-ケトエステルは、シン還元、続く酸処理により、HMGHoA還元阻害剤(スタチン類)の一般的な方法となります。3その後、アルドイミンからケトイミンへと変えることで、アルドイミンよりも高化学収率、高不斉収率を実現しました。4さらに、単一の不斉源であるL-セリンからオキサゾリン環を含むONO型シッフ塩基配位子の設計過程で「擬エナンチオマー」の関係にある二つの化合物が得られ、これを用いることにより、生成物の両鏡像体を高い光学純度で得ることに成功しました。5これらの反応ではいずれも、フェノール性水基のオルト位にかさ高いtert-ブチル基の存在が必須です。
1.2. ONO型三座シッフ塩基からNNP型およびNN型シッフ塩基配位子への展開
ONO型三座シッフ塩基では組み合わされる金属が、チタン、亜鉛、アルミニウムなどに限られるため、次に、NNP型およびNN型シッフ塩基配位子への展開を図りました。フノール性水酸基の代わりにピリジン(もしくはキノリン)の窒素原子を、オルト位のtert-ブチル代わりに合成、入手しやすいキノリル基を用いることとしました。
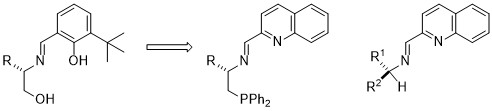
この新規なNNP三座配位子とCu(OTf)2とから調製した触媒を0.1モル%用いることで、エノンへのジアルキル亜鉛による不斉1,4-付加が最高99% eeで進行しました。6同じくキノリンを含むNN二座配位子をCu(CH3CN)4PF6と組み合わせることで、アルケンのアリル位不斉酸化が効率よく進行しました。7中でも、エポキシアルケンのアリル位酸化を利用することで、リン酸オセルタミビ(タミフル)の触媒的不斉合成も達成しました。7c
2) a) M. Hayashi, T. Inoue, and N. Oguni, J. Chem. Soc., Chem. Commun., 341 (1994). b) M. Hayashi, T. Inoue, Y. Miyamoto, and N. Oguni, Tetrahedron, 50, 4385 (1994).
3) a) M. Hayashi, K. Yoshimoto, N. Hirata, K. Tanaka, N. Oguni, K. Harada, A. Matsushita, Y. Kawachi, and H. Sasaki, Isr. J. Chem., 41, 241-246 (2001). b) J. T.Zacharia, T. Tanaka and M. Hayashi, J. Org. Chem., 75, 7514 (2010).
4) a) M. Hayashi, K. Tanaka, and N. Oguni, Tetrahedron: Asymmetry, 6, 1833 (1995). b) T. Tanaka, Y. Sano, and M. Hayashi, Chem. Asian J., 3, 1465 (2008).
5) a) C. H. Chu, K. Morishita, T. Tanaka, and M. Hayashi, Tetrahedron: Asymmetry, 17, 2672―2677 (2006).b) T. Tanaka and M. Hayashi, Synthesis (review), 3361 (2008). c) 田中孝徳,林 昌彦,有機合成化学協会誌, 65, 969 (2007).
6) a) K. Kawamura, H. Fukuzawa, and M. Hayashi, Org. Lett., 10, 3509 (2008). b) K. Kawamura, H. Fukuzawa, and M. Hayashi, Bull. Chem. Soc. Jpn., 84, 640 (2011). c) Y. Ebisu, K. Kawamura, and M. Hayashi, Tetrahedron: Asymmetry, 959 (2012).
7) a) Q. Tan and M. Hayashi, Adv. Synth. Catal., 350, 2639 (2008). b) Q. Tan and M. Hayashi, Org. Lett., 11, 3314 (2009). c) T. Tanaka, Q. Tan, H. Kawakubo, and M. Hayashi,, J. Org. Chem., 76, 5477 (2011).
詳細版
新しいシッフ塩基型キレート配位子の合成とその有機金属錯体を用いた
不斉触媒反応の開発
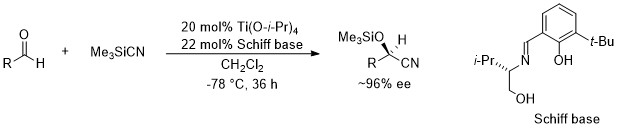
私たちのグループでは、独自に開発したオリジナルな光学活性シッフ塩基を配位子にもつチタンや亜鉛などの有機金属錯体触媒を用いて、種々の炭素求核剤のアルデヒドへの不斉付加反応を行っています。具体的には、光学活性シッフ塩基―チタン触媒を用いたアルデヒドの不斉シリルシアノ化反応、およびジケテンのアルデヒドへの不斉付加反応をこれまでに発表しています。また、ジケテンのアルデヒドへの不斉付加反応を利用してHMG-CoA還元酵素阻害剤の短段階合成を達成しました。
以下の内容については、『第5版実験化学講座第19巻「有機化合物の合成VII 不斉合成・ラジカル反応」』3 不斉炭素―炭素結合合成: 3.1 カルボニル基への不斉1,2-付加反応,大嶌幸一郎編, p. 173―209, 丸善 (2004).『有機合成のための触媒反応103』49.アルキル亜鉛の不斉1,2-付加, 50.アルキル亜鉛の不斉1,4-付加,檜山爲次郎・野崎京子編, p. 98―101, 東京化学同人 (2004).『使える!有機合成反応実践ガイド』丸岡啓二、野崎京子、石井康敬、大寺純蔵、富岡 清編,化学同人(2010)などにまとめています。
1. アルデヒドの不斉シリルシアノ化反応
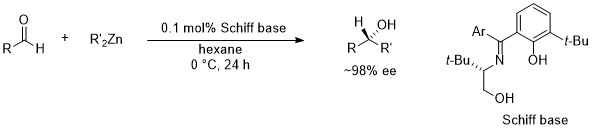
2. ジアルキル亜鉛のアルデヒドへの不斉付加反応
さらに、光学活性シッフ塩基-亜鉛系によるアルデヒドの不斉アルキル化反応を開発しました。この場合、系内にてシッフ塩基とジアルキル亜鉛とから発生した亜鉛錯体が触媒として働いています。
3. ジケテンのアルデヒドへの不斉付加反応
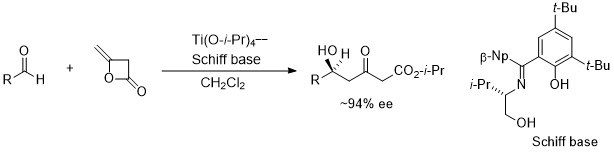
HMG-CoA還元酵素阻害剤の短段階合成
このアルデヒドへのジケテンの不斉付加反応を利用して三段階でコレステロール低下剤フルバスタチンを光学純度 >99.9% eeで合成することに成功しました。これはフルバスタチンの初めての不斉合成例です。
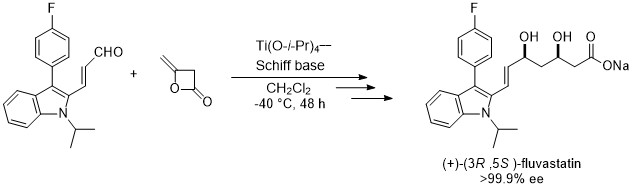
エナンチオ選択性の逆転現象
天然アミノ酸であるL-セリンから二種類のオキサゾリン骨格を持つキラル配位子を合成しました。この二つの配位子はジケテンのアルデヒドへの不斉付加反応において、単一の不斉源から合成したにもかかわらず、それぞれ反対のエナンチオ面を高度に認識することがわかりました。

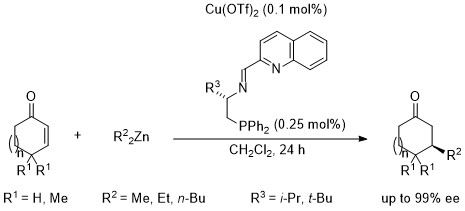
4. 触媒的不斉1,4-付加反応
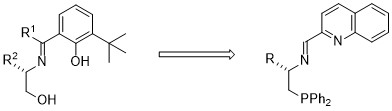
さらに、最近、上記のO,N,O型シッフ塩基を改良した、N,N,P型三座配位子を考案し、エノン類への不斉1,4-付加反応において、0.1モル%の不斉銅触媒の使用で99% eeと高い不斉収率の達成に成功しています。
N,N,P型三座配位子の設計
エノン類へのジアルキル亜鉛の不斉1,4-付加反応
5. 触媒的不斉アリル位酸化反応
私たちは下に示した新規なN,N-二座シッフ塩基配位子を開発し、その銅錯体を触媒に用いることでアリル位の不斉酸化反応を達成しました。特に、メソ型のオレフィニックエポキシドを基質に用いて不斉アリル位酸化反応を行うことで、シクロヘキサン骨格にオレフィンとエポキシド、ヒドロキシ基といった多くの官能基をもつ小分子キラルビルディングブロックの合成に成功しました。これは一度の反応で三箇所の不斉点を生み出すユニークな反応です。再結晶操作により光学純度 >99% eeで生成物が得られます。この生成物を鍵中間体に用いることにより、様々な生理活性化合物を合成することができます。
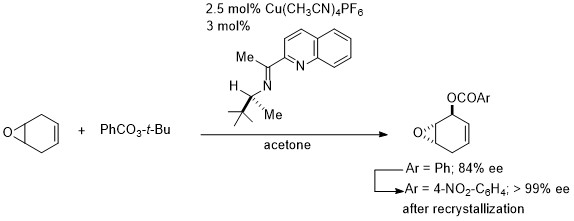
本反応を利用して、リン酸オセルタミビル(タミフル)の触媒的不斉合成を達成しました。
有機合成の目的の一つは生理活性化合物、医薬品の合成です。ただ、ここで強調しておきたいことは、私たちは、最初からフルバスタチンやタミフルの不斉合成を計画していたわけではないということです。それぞれ、キラルチタン触媒によるアルデヒドへのジケテンのエナンチオ 選択的付加反応、キラル銅触媒による不斉アリル化反応を独自に開発できたからこそ、その反応を利用してフラバスタチンやタミフルの不斉合成を行ったわけです。したがって、この手法の一般性は高く、あらゆるスタチン系の究極の短段階合成に用いることができ、また、タミフル誘導体の合成も可能です。
最初から、標的化合物を設定してしまうと、当初の理想とする合成計画通りにいかない場合、次善の策、さらには次々善の策を選んでいくことになり、理想の合成計画から外れてしまいます。 私たちは、常に、「簡潔・明快・論理的」に進めることを目指しています。
