【微生物(酵母,大腸菌,放線菌,水素細菌など)を利用した
有用物質生産に関する研究】:蓮沼G
有用物質生産に関する研究】:蓮沼G
<背景>
微生物は古くから様々な有用物質(アルコール,アミノ酸,核酸,有機酸,脂質,ビタミン,抗生物質など)の生産に用いられてきました。発酵はその一例で,特定の有用物質の生産に優れた微生物が単離され,工業的に利用されてきた歴史があります。
微生物の改良は育種と言われ,遺伝子に変異導入された微生物の中から物質生産能の高いクローン(株)が選抜(スクリーニング)され,利用されてきました。また,遺伝子組換え技術を利用して細胞内で特定の遺伝子の発現を強化あるいは抑制することで,微生物の物質生産能力を向上させることも可能です。
近年は,バイオインフォマティクス,データ解析技術が発展して遺伝子の機能解析が進むとともに,ゲノム編集に代表される先端的な遺伝子工学技術が開発されてきたことで,精密な代謝経路設計や遺伝子配列設計,微生物構築が可能になってきました1)。
<研究内容>
 当研究室では,酵母や大腸菌,放線菌,水素細菌などの微生物を研究対象とし,その代謝メカニズムの理解を進めるとともに,基礎学理を応用した有用物質生産株の開発と有用物質生産プロセスの開発に取り組んでいます2,3)。
当研究室では,酵母や大腸菌,放線菌,水素細菌などの微生物を研究対象とし,その代謝メカニズムの理解を進めるとともに,基礎学理を応用した有用物質生産株の開発と有用物質生産プロセスの開発に取り組んでいます2,3)。
有用物質としては,人の暮らしを豊かにする機能性分子(芳香族系化合物,二次代謝物質,ペプチドなど)や医薬品原料,従来,石油化学で製造されてきた汎用化学品,プラスチック,液体燃料などを対象とし,これらを経済的に,かつ,環境に負荷をかけない手法で効率的に生産する技術の開発に取り組んでいます3-6)。
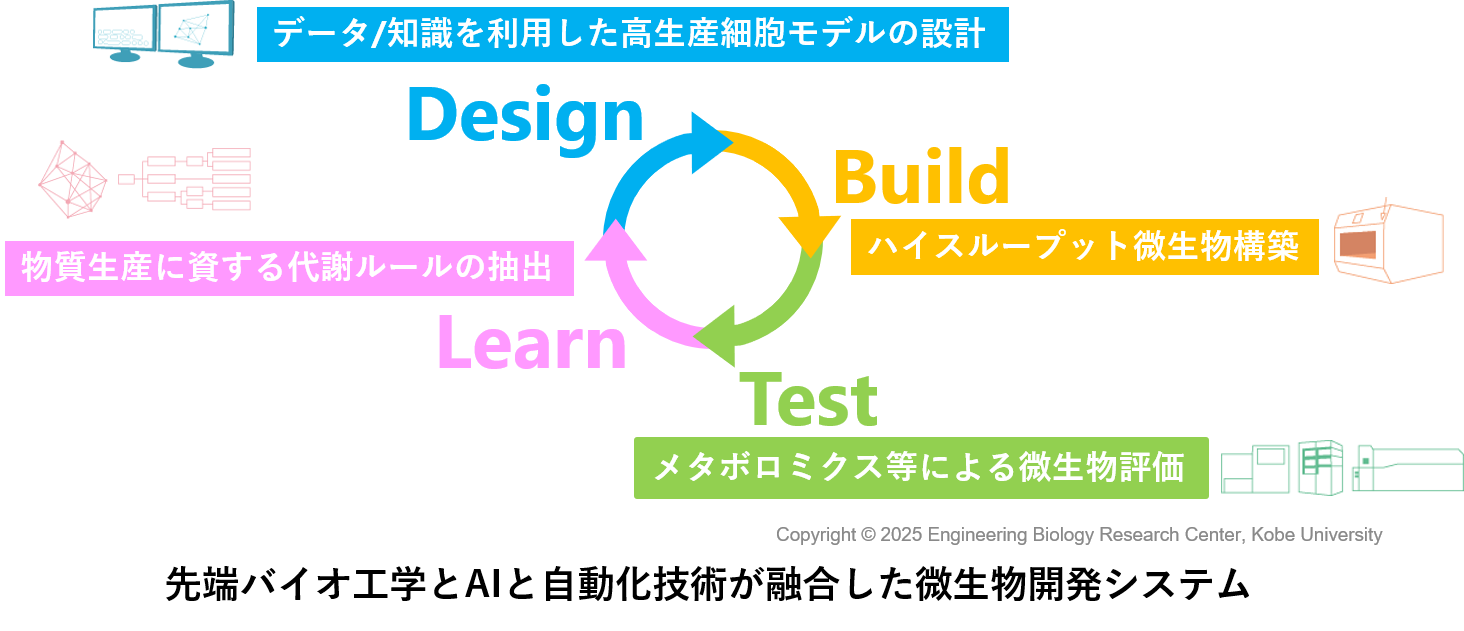
有用物質生産株の開発に際しては,最先端の遺伝子工学技術を利用するだけでなく,最先端の自動実験システム(世界初の自律型実験システム7)),メタボローム解析をはじめとする先端計測技術,機械学習等のバイオインフォマティクスを用いることで,有用物質の生産に優れた新規微生物株を作出しています3,6-8)。
また,このような要素技術を組み合わせることで,Design(設計)-Build(構築)-Test(評価)-Learn(学習)を一気通貫する最先端の実験ワークフローを構築し,その有効性を検証する研究を進めています。このような,バイオとデジタル(AIおよびロボティクス)を融合した世界初の微生物育種ワークフローを構築することで,従来と比べて飛躍的な物質生産性向上を実現しています3,8)。
ここで強調したいことがあります。効率的な有用物質生産を実現するためには微生物の代謝を理解することが欠かせません。当研究室では,微生物が持つ酵素の働きや代謝制御メカニズム,遺伝子発現などをはじめ,生物の未知機能を明らかにし,基礎的な学理の探索をしたうえで,それを応用研究につなげることとしています。
<主な研究成果, 総説>
- 蓮沼誠久(監修), 微生物を活用した有用物質の製造技術, シーエムシー出版 (2023)
- Hasunuma, T., et al., Microbial Cell Factories, 10: 2 (2011)
- Vavricka, C.J. , et al., Nature Communications, 10, 2015 (2019)
- Kumokita, R., et al., Bioresource Technology, 393, 130144 (2024)
- Bamba, T., et al., Metabolic Engineering, 56, 17-27 (2019)
- Vavricka, C.J. , et al., Nature Communications, 13, 1405 (2022)
- Fushimi, K., et al., Scientific Reports, 15, 6648 (2025)
- Hidese, R., et al. ACS Catalysis, 15, 11931-11943 (2025)
<プレスリリース>
- 2025/03/12 神戸大学 HP 他, 実験から仮説を自動立案する自律型実験システムの有用性を実証
- 2024/11/12 神戸大学 HP, プロポリス主成分の微生物生産における世界最高値を10倍以上更新
- 2023/12/26 神戸大学 HP, 石油依存からの脱却! バイオフェノールの生産性を向上させる新技術を開発
- 2023/11/17 Natureオンライン, Elevating experimental design through automation
- 2022/07/07 読売新聞, <知のリレー> 微生物 ミクロの工場 薬やバイオ燃料 生産
- 2021/12/10 神戸大学 HP 他, 世界初のロボット対応LCとLC-MSを含む『自律型実験システム』を島津製作所と有用性検証
◆本研究に関する問い合わせ先◆
蓮沼 hasunuma@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【CO2を原料とした有用物質生産に関する研究】:蓮沼G
<背景>
現代社会ではプラスチックをはじめ,繊維,ゴム,溶剤,塗料,洗剤,液体燃料など多くの材料の生産が石油化学に依存しています。しかしながら,これ以上の石油の利用拡大は資源の枯渇や環境負荷の増大を深刻化させるため,対策が必要です。
再生可能な植物系バイオマスから得られる糖や脂質を原料とし,微生物による発酵で汎用化学品を製造することは対策の一つとして有望です。
一方で,こうした発酵用炭素源の入手には経済性が求められ,生態系への影響も少なくありません。数十年先を考えた場合,植物の耕作可能地や淡水の利用も限界があり,植物系バイオマスの供給が困難になる可能性があります。
こうした中で,微細藻類やシアノバクテリア(ラン藻)は,光環境下でCO2を吸収し,様々な有用物質(プラスチック,オイル,多糖,色素,機能性脂質など)を直接生産することが可能です。海洋性の藻類を利用すれば,耕作地や淡水資源の制約を回避することができます。近年は,遺伝子組換えが可能な種が増えており,藻類が元々作らない有用物質を生産させることも可能になっています。Cupriavidus necatorに代表される水素酸化細菌は,水素による還元力を利用してCO2をプラスチックや有機酸に変換することが可能です。
 <研究内容>
<研究内容>
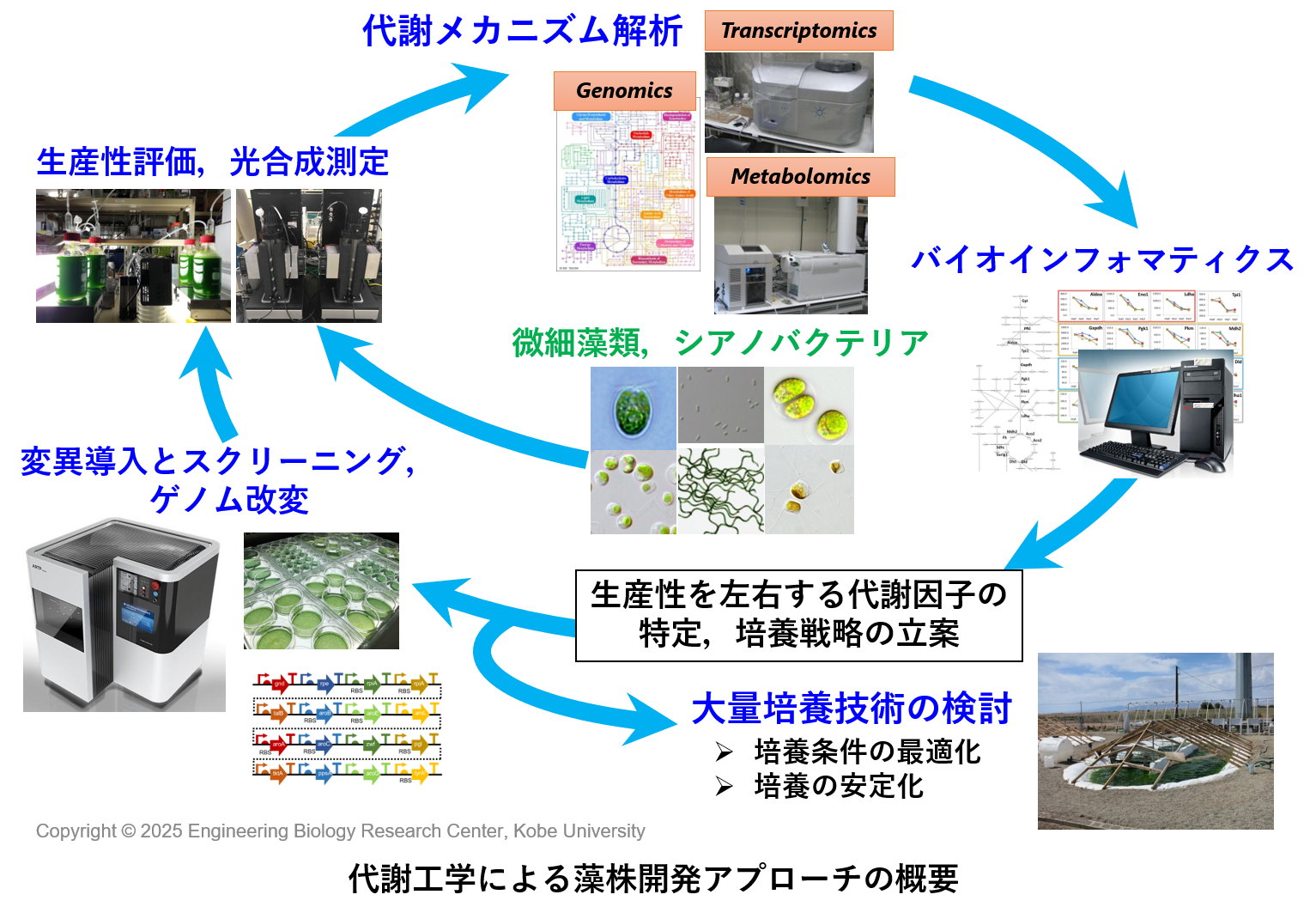
当研究室では,ラン藻(シネコシスティス,シネココッカス,スピルリナなど)や緑藻(クラミドモナス,クロレラ,ヘマトコッカスなど),ハプト藻や紅藻などを研究材料とし,様々な有用物質(プラスチック,オイル,デンプン,グリコーゲン,カロテノイド,コハク酸,D-乳酸,チロシンなど)の生産に取り組んでいます9-12)。また,水素酸化細菌を利用したCO2からのプラスチック生産にも取り組んでいます。培養はガスを原料にして取り組んでいることが特色になっています。
研究アプローチの例としては,物質生産や光合成の基礎データを収集した後,メタボローム解析などの先端計測や情報処理を通して生産性を左右する因子の探索や培養戦略の立案を行います。その後,培養のスケールアップに進んだり,株の育種や選抜(スクリーニング)を行い,再度,基礎データを収集するなどします。
基礎的な代謝メカニズムの理解に取り組み,生物の未知機能の探求を進めながら,応用研究に取り組んでいます13)。
<主な研究成果, 総説>
- Aikawa, S., et al., Energy and Environmental Science, 6, 1844-1849 (2013)
- Hidese, R., et al., ACS Synthetic Biology, 11, 4054-4064 (2022)
- Hasunuma, T., et al., Metabolic Engineering, 48, 109-120 (2018)
- Inabe, K., et al., Metabolic Engineering, 88, 228-239 (2025)
- Hidese, R., et al., Communications Biology, 6, 1285 (2023)
<プレスリリース>
- 2025/02/17 神戸大学HP, 生分解性プラスチックの短期間での高生産に成功
- 2024/07/03 Nature Focal Point, Sustainable Food Supply in Japan 特集, Making lab-grown meat more sustainable
- 2023/12/26 神戸大学HP, 警告物質が窒素利用を制御する作用点を解明
- 2023/01/10 神戸大学HP, 光合成が始まる瞬間の代謝機構を解明
- 2021/05/06 神戸大学HP, Microalgae biofuels: Changing carbohydrates into lipids
◆本研究に関する問い合わせ先◆
蓮沼 hasunuma@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【細胞表層工学を用いたバイオマスの有効利用に関する研究】:蓮沼G
<背景>
地球上の炭素循環の定常化や持続的なエネルギー供給を実現するため,現代の生活に必要な様々な有用物質(液体燃料,汎用化学品,機能性素材など)を生物資源(バイオマス)から製造することが期待され,このコンセプトはバイオリファイナリーと呼ばれています。この際のバイオマスには食糧と競合しない資源が好ましく,地球上の賦存量が多いリグノセルロース系バイオマスの有効利用が望まれています。
一方,リグノセルロース系バイオマスは構造が強固で分解されにくいため,分解に対するエネルギー投入が課題になっています。その構造は水素結合により結晶化したセルロースをヘミセルロースやリグニンが強化する多層構造を呈しており,微生物発酵の原料とすることが困難になっています。
<研究内容>
当研究室では,微生物の細胞表層にセルロース分解酵素やヘミセルロース分解酵素を集積させることにより,リグノセルロース系バイオマスに対する分解能を付与した微生物を開発しています。
細胞の表層にタンパク質を固定・集積する技術を細胞表層工学技術として確立し,これまでにさまざまな酵素の細胞表層提示を行ってきました14-17)。酵素の提示量を調節することや,複数の酵素を立体的に配置することも可能になり,リグノセルロース系バイオマスの分解効率を向上させてきました16,17)。
細胞表層を改変した微生物に,有用物質の生合成経路を導入することで,リグノセルロースから有用物質を直接生産することも可能になっています。
現在はさらなる表層提示効率の向上,表層提示酵素の検討,適用微生物種の拡大などに取り組み,バイオマスを有効に利用する生物プロセスの開発に取り組んでいます。
細胞表層工学で開発した微生物は「酵素を集積した高機能生物触媒」とみなすことができ,微生物ごと酵素をリサイクルすることもできます。そこで最近は,このような微生物を用いた機能性食品素材の繰り返し生産プロセスの開発にも取り組んでいます18)。

<主な研究成果, 総説>
- Guirimand, G., et al., Green Chemistry, 21, 1795-1808 (2019)
- Hasunuma, T., et al., Biotechnology Advances, 30(6), 1207-1218 (2012)
- Bamba, T., et al., Current Opinion in Green and Sustainable Chemistry, 33, 100584 (2022)
- Inokuma, K., et al., Metabolic Engineering, 57, 110-117 (2019)
- Inokuma, K., et al., Scientific Reports, 14, 18540 (2016)
<プレスリリース>
- 2019/12/09 神戸大学HP, 「酵母の細胞表層における異種タンパク質の立体配置を制御する技術を開発 -細胞の機能性向上に成功-」
- 2019/03/18 神戸大学HP, 「酵母を用いて木材パルプからキシリトールとセルロースファイバーの併産に成功」
◆本研究に関する問い合わせ先◆
蓮沼 hasunuma@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【メタボローム解析技術の開発と代謝メカニズム解析,
代謝工学やバイオプロセスへの応用】:蓮沼G
代謝工学やバイオプロセスへの応用】:蓮沼G
<背景>
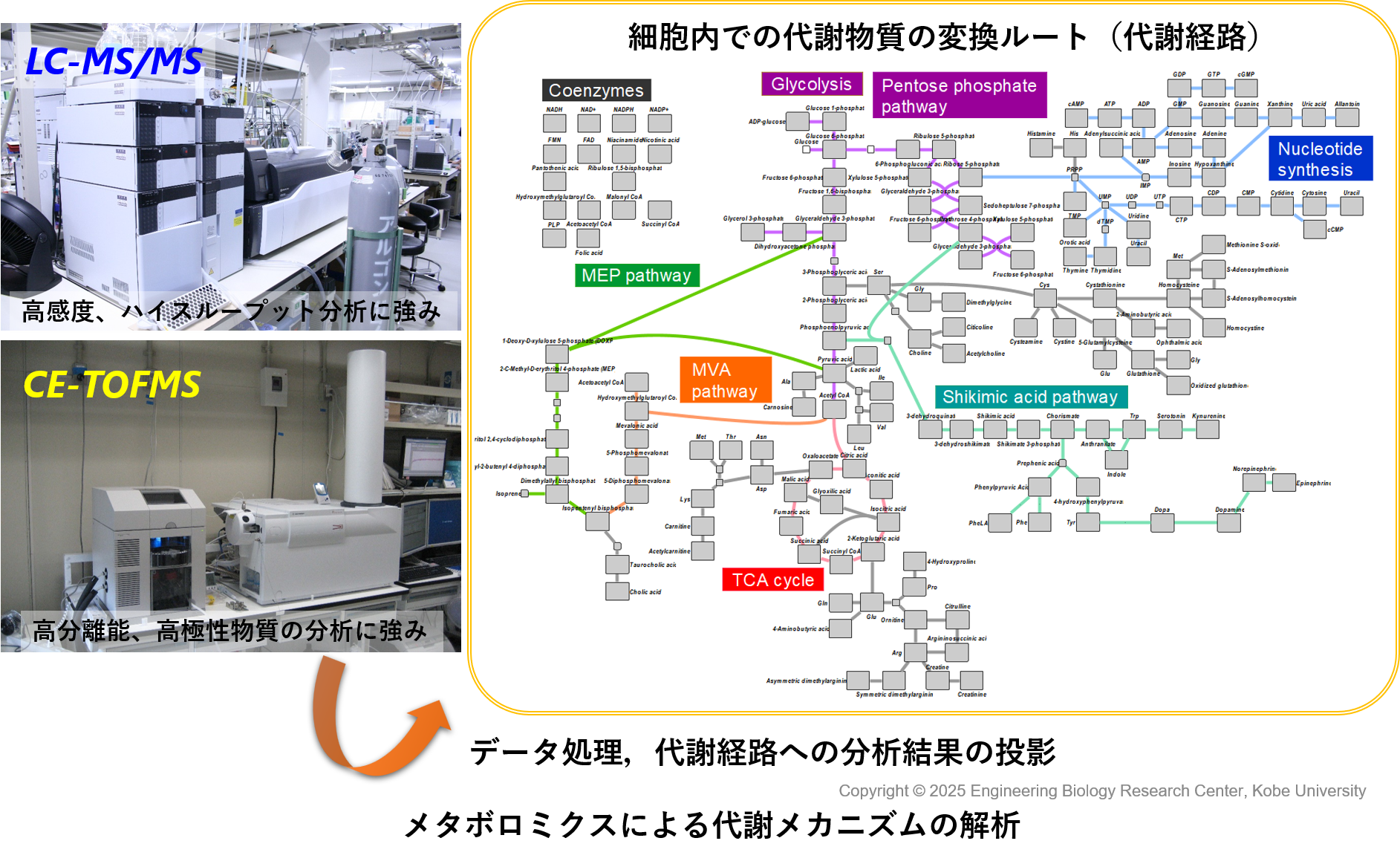
 メタボローム解析は,培養中の細胞から代謝物質を抽出し,質量分析計(LC-MS/MSやCE-TOFMS,GC-MS)等を用いて,多数の代謝物質の存在量を一斉に分析する手法です。
メタボローム解析は,培養中の細胞から代謝物質を抽出し,質量分析計(LC-MS/MSやCE-TOFMS,GC-MS)等を用いて,多数の代謝物質の存在量を一斉に分析する手法です。
一般に,細胞の中ではDNAが転写されてRNAが生成し,RNAを利用して酵素を含むタンパク質が形成されます。メタボローム解析は酵素反応で生成・分解する低分子化合物(代謝物質)を網羅的に測定するため,複雑な細胞システムの表現型を特徴づけることができます。
微生物では,細胞内に存在する代謝物の種類は数千以上といわれています。代謝物の種類や量は,細胞の生育環境や遺伝的背景に依存するため,メタボローム解析を行うことで物質生産に適した培養条件やゲノム配列を捉えることが可能になります。
例えば,細胞が特定の物質を高生産する際,メタボローム解析を行うと,多様な細胞内代謝物質の中から「高生産に寄与する分子種」を選び出すことが可能になります。そうすれば,その分子種の増減を測定することにより,物質生産に適した培養条件や細胞の選定が可能になります。
<研究内容>
当研究室では、独自のメタボローム解析技術を開発して生物の代謝メカニズムを解析するとともに、これを代謝工学やバイオプロセス工学に応用することでオリジナリティの高い研究成果を導出してきました19-22)。
1)メタボローム解析技術の開発と代謝メカニズム解析
 従来のメタボロームデータは細胞を採取した瞬間のスナップショットデータでした。言い換えると,代謝物の合成・分解の時間変化についての情報を得られませんでした。そこで,安定同位体炭素を用いたin vivo 13C標識技術や,安定同位体窒素を用いたin vivo 15N標識技術を,メタボローム解析技術と組合せることにより,代謝物のターンオーバーを網羅的に観測できる技術を開発し,これを「動的メタボロミクス」と名付けました23,24)。動的メタボロミクスを用いると,13Cや15Nの動態を追跡することにより,各代謝経路への炭素原子や窒素原子の分配や,代謝経路中の律速段階が明らかにすることができます。
従来のメタボロームデータは細胞を採取した瞬間のスナップショットデータでした。言い換えると,代謝物の合成・分解の時間変化についての情報を得られませんでした。そこで,安定同位体炭素を用いたin vivo 13C標識技術や,安定同位体窒素を用いたin vivo 15N標識技術を,メタボローム解析技術と組合せることにより,代謝物のターンオーバーを網羅的に観測できる技術を開発し,これを「動的メタボロミクス」と名付けました23,24)。動的メタボロミクスを用いると,13Cや15Nの動態を追跡することにより,各代謝経路への炭素原子や窒素原子の分配や,代謝経路中の律速段階が明らかにすることができます。
また,最近は煩雑な前処理工程(培養液から細胞を回収し,回収した細胞から代謝物を抽出する工程)を自動化した前処理システムを開発することで,分析の精度および感度が向上し,より多様な代謝物質を再現性高く解析できるようになったため,これまでノイズの中に隠れていた生物現象を発見することができるようになってきています。
本研究では,メタボローム解析技術や動的メタボローム解析技術を駆使して,代謝経路全体を広く俯瞰するとともに,代謝物質の蓄積量変化や合成・分解速度(ターンオーバー)を分子レベルで観測し,細胞システムにおける代謝制御メカニズムを調べる研究に取り組んでいます。
2)メタボローム解析に基づく物質生産やバイオプロセス開発への応用
本研究では,微生物のメタボローム解析や動的メタボロミクスを行うことで,代謝経路のボトルネックを探索し,ボトルネックを触媒する酵素反応の強化を行うなどして,細胞の物質生産能力の向上に取り組んでいます19)。こうした代謝解析のアプローチは,微生物が受ける環境ストレスに対する耐性能力の付与にも適用できます2)。
また,微生物のメタボロームや細胞外への生成物を分析すると,培養時の細胞状態を推察することができます。このようなデータをもとに,目的物質の生産量を向上させるための培養条件を検討し,バイオプロセスの開発へ向けた研究を行っています。
<主な研究成果, 総説>
- Tanaka, K., et al., Current Opinion in Biotechnology, 85, 103057. (2024)
- Tanaka, K., et al., Plant Physiology, 191, 2400-2413 (2023)
- Kato, Y., et al, Bioresource Technology, 344, 126196 (2022)
- Vavricka, CJ., et al., Trends in Biotechnology, 38, 68-82
- Hasunuma, T., et al., Journal of Experimental Botany, 61(4), 1041-1051 (2010)
- Inabe, K., et al., Metabolites, 11, 867 (2021)
<プレスリリース>
- 2018/05/25 日本経済新聞, 産経新聞, 京都新聞, 日刊工業新聞, 化学工業日報, 日経バイオテク, 神戸大学HP, 「細胞の代謝物をハイスループット分析可能な解析技術を開発 ―多種類・高感度・自動化により、スマートセルインダストリーの実現に貢献―」
- 2017/04/05 神戸大学HP, 「独自に開発したメタボローム解析技術により藻類のオイル生産メカニズムを解明 ― 微細藻類を用いたバイオ燃料の生産向上に期待 ―」
◆本研究に関する問い合わせ先◆
蓮沼 hasunuma@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【より精密で安全なゲノム編集技術の開発】:西田G
ゲノム編集技術とは、生きている生物ゲノムの情報を迅速かつ簡便に編集(改変)できる技術を指します。特に2012年に発表されたCRISPR/Casシステムを用いる技術は、従来技術に比べて使いやすく、安定して高効率に機能し、かつ汎用性に優れるため、生命科学全般に波及する革新的技術として利用が急速に進んでいます。CRISPR/Casシステムの利用により、微生物による物質生産から植物育種、そして動物やヒトなどの医療分野に至る、実に幅広い応用の可能性が拓けてきています。
一般的なCRISPR/Casシステムを利用したゲノム編集では、DNA鎖を切る酵素であるヌクレアーゼの活性により標的となるゲノムのDNA配列において二本鎖切断を引き起こすことで、細胞によるDNA修復過程を誘導し、その過程における偶発的な修復エラーによって変異が導入されることを期待します。最も起こりやすい変異は、切断箇所にDNA塩基の欠失あるいは挿入が生じることであり、これにより目的遺伝子の機能を喪失させることができます(図1A)。しかし、これでは変換後の配列がランダムになりますので、より精密な遺伝子の書き換えによって高度な機能改変を行いたい場合においては、相同組換え修復を介した手法が開発されてきました。この手法では、標的DNA配列の二本鎖切断と共に、相同な配列を有する鋳型 DNAをゲノム中へ供給することにより、上記とは別の相同組み換え修復反応を誘発することにより、DNA配列を入れ替えることができます。ただし、この反応は常に優先して起こるわけではなく、上記の欠失・挿入と入り混じった結果になったり、そもそも細胞によっては反応を誘発するに足る十分量の鋳型DNAを送り込むことの技術的難度、また実際の効率の低さが課題となっています。また細胞によってはDNA二重鎖切断の毒性が非常なストレスとなって修復できずに死んでしまうケースも少なからずあります。
このようなゲノム編集の課題に対して、私たちのグループでは、高精度に標的塩基塩基配列を書き換える塩基編集技術「Target-AID」を開発しました。本技術は、CRISPR/Cas システムからヌクレアーゼ活性を除去し、代わりにDNA脱アミノ化酵素であるデアミナーゼを付加した人工酵素複合体を構築し、これにより狙った点変異を高効率に導入するものです(図1B)。Target-AIDは、その毒性の低さからCRISPR/Cas システム以上に高い汎用性を有し、バクテリア、酵母、動物、植物において標的塩基置換による遺伝子機能改変を実証しています(図2)。本技術は、有用生物の育種から疾患研究、創薬開発などを加速させる強力なツールとなり、将来的には新たな遺伝子治療手法としての応用も期待されます。現在は、実際に有用生物を作出したり、より高精度な Target-AID への改良や、Target-AID を用いた大規模スクリーニング系の開発を始め、さらに新たなゲノム編集技術の開発などの研究に取り組んでいます。
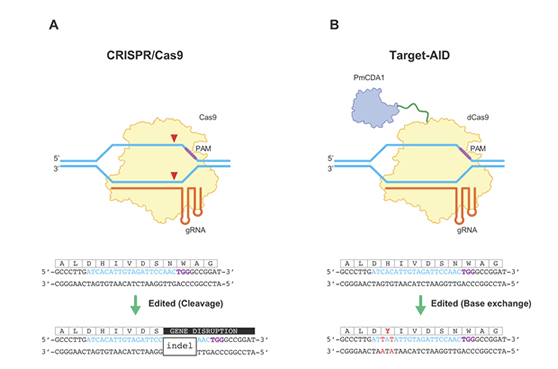
図1
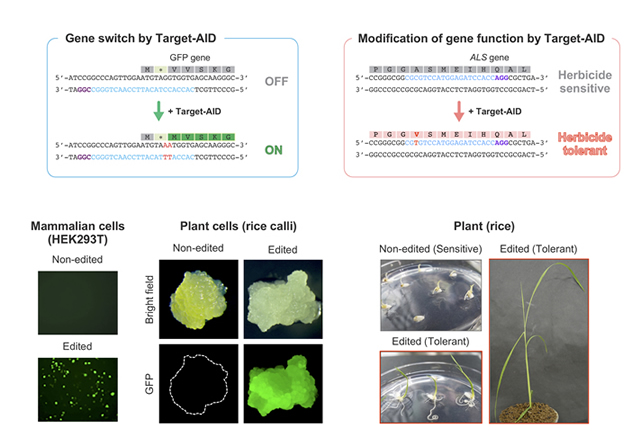
図2
◆本研究に関する問い合わせ先◆
西田 keiji_nishida@people. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【バイオ医薬品の生産プロセス技術開発と
その規制に関する研究】:内田G
バイオ医薬品や遺伝子治療薬、細胞医薬などのバイオロジクスの発展は目覚ましく、近年、低分子医薬では達成できない治療効果をあげ注目されています。一方、バイオロジクスの製造には、高度な科学と生産技術が必要とされ、誰もが容易に行えるものではありません。バイオロジクスの代表選手であるバイオ医薬品の研究・開発・製造には、ゲノム編集を含む遺伝子操作技術、たんぱく質化学、細胞工学、培養工学、分離科学、分析科学などの幅広い基本的な科学技術を組み合わせて再構築したプロセスサイエンスが必要となります。さらに医薬品として市場に出すためには、患者さんの安全性を担保するために、それらのプロセスサイエンスをベースとした規制科学(レギュレタリ―サイエンス)も必要となります。
私たちは,バイオ医薬品のプロセスサイエンスに幅広く取り組みつつ、バイオ医薬品の典型例として、CHO細胞による抗体医薬の製造工程を研究材料とし,抗体を効率良く生産するCHO細胞の構築やバイオ医薬品の従来のバッチ生産から連続生産への展開した場合に求められる生産技術に関する研究や遺伝子治療に必要なウイルスベクターの製造方法に関する研究に取り組んでいます。
この研究に関連し、プロセスサイエンスを担う人材の育成を行う一般社団法人バイオロジクス研究・トレーニングセンター(BCRET)を神戸大学の関連組織として設立しています。
- Tojo.S. et al., Biol Pharm Bull 2009 Sep;32(9):1604-8
- BCRETホームページ
◆本研究に関する問い合わせ先◆
内田 kazuhisa.uchida@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【バイオ医薬品の開発・製造・品質管理等に関わる
人材育成のための教育プログラムの開発】:内田G
日本の製薬業界は、バイオ医薬品の開発・製造に関する技術的な点で海外の企業に遅れを取っていて、日本発のバイオロジクス製品は数が非常に少ないのが現状です。そこで、国内でのバイオ医薬品に係る産業の強化のため、バイオ医薬品の開発や製造の基盤技術を担う人材の育成が急務と考えられるようになり、当研究室では、産・学・官の共同でそのような人材育成のための教育プログラムの開発を行い、課題解決に取り組んでいます。
≪実際の活動≫
・本学及び次世代バイオ医薬品製造技術研究組合(MAB)所有のGood Manufacturing Practice(GMP)準拠製造施設を活用して、製薬企業の社員、審査やGMP適合性調査に関わるPMDAの査察官、バイオに興味を持つ学生等に対する教育プログラムを作成。
・製薬企業などで働く実務経験者と接しながら、バイオ医薬品のみならず細胞医薬のような新医薬品の開発、新製造技術、新分析技術や医薬品の承認に関する規制の国際的な動向を取り込む。
・開発した教育プログラムは一般社団法人バイオロジクス研究・トレーニングセンターで活用。

シングルユース設備によるCHO細胞の浮遊培養の様子
◆本研究に関する問い合わせ先◆
内田 kazuhisa.uchida@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【バイオ医薬品のウイルス安全性を高める
技術開発に関する研究】:内田G
バイオロジクスの多くは、動物細胞を用いて生産するため、製品である医薬品に人体に障害を与えるウイルスが迷い込む可能性が否定できません。そのため、製造に用いる原料や動物細胞がウイルスに汚染されていないかの否定試験や製造工程自体にウイルスを不活化したり除去したりする能力があるかといったことを評価し試験する必要があります。国内ではこういった研究が十分に行われていないため、当研究室でこれらに関連する技術の確立を行ってきました。
今年度からはステージを進めて、バイオ医薬品の製造に用いられるCHO細胞に、次世代シークエンシングやゲノム編集技術を用いを行い、ウイルスに感染しないウイルス耐性のホストCHO細胞の構築手法の開発等に取り組みます。また、最新の製造方法となるバイオ医薬品の連続生産で必要となるウイルス不活化技術の開発に取り組みます。
- Yuan Y. et al., PLoS One (2013) 8: E65115
- Yuan Y. et al., Virology (2011) 413: 293-299
◆本研究に関する問い合わせ先◆
内田 kazuhisa.uchida@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【合成生物学のための遺伝子パーツ開発と
人工配列設計による代謝改変細胞構築】:石井G
合成生物学は,遺伝子やプロモーター,シグナル配列などのDNA構成要素(遺伝子パーツ)を組みあげることで,“新しい生物機能”を人工的につくりだす研究として注目を集めています。たとえば,新たなタンパク質の発現系や代謝経路など自然界には存在しないシステムを設計し,遺伝子パーツの組み合わせによりそのシステムを再現するDNA配列を構築します。構築したDNA配列を細胞に導入することで新しい機能をもつ細胞を人工的に作りだしたのち,その人工改変細胞の機能を詳細に解析することで欠陥や性能に問題のあるシステムや遺伝子パーツを特定し,さらなる改良を施します。こうした合成生物学の研究では人工遺伝子回路による制御や進化工学などさまざまなアプローチがあり,たとえば回路トポロジーの修正やパーツの改良などを行います。
こうした合成生物学の研究を進めるために,私たちのグループでは,大腸菌などの原核生物に比べて遺伝子や細胞の構成要素が複雑で工学が困難とされる真核生物(出芽酵母など)を主な対象としてさまざまな遺伝子パーツのラインナップ化や性能の向上・改質に取り組んでいます。具体的には,DNA配列の合理的な設計を考えたり,ランダムな変異導入によりバリエーションを発生させてその中から望ましい性能を示すものを取り出す作業を行ったりしています。とくに,遺伝子の発現パターンを緻密にコントロールできる“遺伝子スイッチ”や代謝物の濃度変化を簡便にモニタできる“メタボライトセンサ”の開発に注力して研究を進めています。また,これらの基盤技術を活用して人工的な遺伝子配列や回路を設計することで,さまざまな有用物質を高生産する代謝改変細胞を構築する研究も行っており,合成生物学を産業に応用する取り組みも進めています。
.png)
合成生物学のための遺伝子パーツ開発と人工配列設計による代謝改変細胞構築
.png)
人工遺伝子スイッチの開発
<主な研究成果>
- Ito, Y. et al (2020/12) Nucleic Acids Research, 48(22), 13000-13012
- Tominaga, M. et al. (2021/03) Nature Communications, 12, 1846
<プレスリリース>
- 2020/12/01 Research at Kobe, 「ピキア酵母においてターミネーター配列が RNA安定性と遺伝子発現量を制御していることを発見 – タンパク質の発現を最適化する技術として期待 –」
- 2021/03/24 Research at Kobe, 「酵母の遺伝子スイッチを人工的に作りだす新たな手法を開発」
◆本研究に関する問い合わせ先◆
石井 junjun@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【バイオ医薬品の高生産宿主および候補分子選択技術の開発】:石井G
バイオ医薬品は,生体分子に由来することから生物学的製剤(バイオロジクス)とも呼ばれており,高い特異性や副作用の低減が期待できることから創薬の主流になりつつあります。バイオ医薬品としてよく利用されている抗体(フルボディ抗体)は,多様な標的に対して特異的な結合性をもつタンパク質であり,近年では抗体の結合ドメインのみを利用する低分子抗体や人工的に設計された抗体様タンパク質などの開発も進んでいます。フルボディ抗体はチャイニーズハムスター卵巣細胞(CHO細胞)を宿主として主に生産されていますが,比較的分子量の小さい低分子抗体などのタンパク質は増殖が早く安定株の作出も容易な微生物での生産が可能であり,新たなバイオ医薬品の生産宿主としての利用が期待されています。
我々のグループでは,増加し続ける医療費を削減することを目標として,主に微生物を利用した低分子抗体等のバイオ医薬品生産宿主の開発に取り組んでいます。具体的には,高密度培養が可能かつタンパク質の分泌生産能の高いことで知られる産業用酵母(Pichia pastoris等)を宿主として,低分子抗体などのタンパク質分泌能力に関わる有用因子を同定したり,遺伝子工学的手法や合成生物学的手法を駆使することで生産能力を向上させる研究を進めています。生産した低分子抗体は,がん細胞に対する細胞障害性やCHO細胞由来の抗体との比較などの評価を行い,新たな構造を有する低分子抗体の設計に役立てたりしています。
また,抗体以外のバイオ医薬品候補分子として,生体内の様々な制御機構や生理現象に関わるシグナル伝達やタンパク質間相互作用(PPI)を制御できるタンパク質やペプチドを選別できる技術の開発にも取り組んでいます。たとえば,真核生物のモデルである出芽酵母(Saccharomyces cerevisiae)のシグナル伝達機構と緑色蛍光タンパク質(GFP)などのレポーター遺伝子を利用してバイオ医薬品候補となる分子を選別できるバイオセンシング技術を開発してきており,ヒト由来Gタンパク質共役型受容体(GPCR)に対する作動薬やPPIを選択的に阻害する分子のスクリーニングを行っています。
.jpg)
バイオ医薬品(低分子抗体などのタンパク質)の高生産宿主開発
.jpg)
バイオ医薬品候補分子(作動薬や阻害薬)の選択技術
<主な研究成果>
◆本研究に関する問い合わせ先◆
石井 junjun@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。
【枯草菌を用いた長鎖DNA合成技術の開発】:柘植G
2017年に始まったThe Genome Project – Write (GP-W) など、世界で生物のゲノムを設計し、実際に構築する試みが活発となっている。任意の配列のDNAを構築するためには化学合成DNAを出発材料にする必要があるが、化学合成DNAは、一本鎖DNAとして合成され、その長さはせいぜい数100塩基程度と短いため、これらを紡いで長いDNAにする必要がある。紡ぐ方法としては、まず化学合成DNAをある程度の長さ(数100 bp~数kbp)の長さの二本鎖DNAに試験管内で準備後、生物を用いて長いDNA(例えば100 kbp以上)に集積する必要がある。集積する方法は、出芽酵母を用いる系がよく利用されているが、操作が簡単な反面、集積の正確性に問題がある場合もあり、増殖が遅く、構築した長いDNAを大量に精製するのが困難といった問題点があった。
当研究グループでは、DNAを集積する生物に枯草菌というバクテリアを用いるユニークな方法を開発している。第二世代OGAB法という、枯草菌を用いる遺伝子断片集積法は、世界最多となる50個を超えるDNA断片を一度に正確に連結可能で、これにより長鎖DNAを短期間に構築できる。さらに増殖も速く、構築した長いDNAを大量に調達しやすいというメリットがる。一方、集積に用いる材料となるDNA断片のモル濃度を全てのDNA断片で同じ(等モル)にする必要があるがこの操作には熟練を要するため、この部分が第二世代OGAB法の弱点となっていた。
当研究グループでは、これを克服するために、DNA断片のモル濃度を自動的に調整する装置をプレシジョン・システム・サイエンス株式会社と開発した。また、長鎖DNA合成に適したDNA化学合成装置を日本テクノサービス株式会社と開発した。さらに液体分注ロボットを用いた迅速な二本鎖DNAの調達技術を開発するなど、一連の工程を自動化する第二世代OGAB法自動化のトータルシステムを構築した。現在は、本システムを利用した長鎖DNA合成技術の、有用物質生産や、医療などへの展開を念頭においた研究を行っている。

◆本研究に関する問い合わせ先◆
柘植 ktsuge@port. ※アドレスの後ろに kobe-u.ac.jp を付けてください。

