動物・昆虫細胞培養による有用物質生産
1.はじめに
すべての生物は細胞からできています.ヒトなどの動物の体の中では,細胞は集合して種々の組織や器官を形成し,互いに協力しながらそれぞれ特定の機能を発現することによって,生物個体として統制のとれた複雑で高度な生命活動を営んでいます.このような細胞を個体から離れた人工的な環境の下で生育させる技術が細胞培養技術です.細胞を生体外で培養することにより,複雑な生命現象をより単純化した系で取り扱うことができるため,細胞培養技術の進展は生命現象の解明に向けて多大な貢献をしてきました.一方,応用面でも,細胞培養技術はウイルスワクチンの製造に利用されたのを皮切りに,現在ではインターフェロン,エリスロポエチン,モノクローナル抗体などのバイオ医薬品の生産手段として不可欠なものとなっています.最近ではまた,遺伝子治療や再生医療における利用も検討されています.ここでは,このような細胞培養技術の応用について,我々の取り組みを中心に紹介したいと思います.
2.細胞培養による有用物質生産
動物の生体内において,ある種の細胞はホルモンやサイトカインなどの種々の生理活性物質を生産・分泌し,別の細胞がこれらを受け取ることによって,細胞の機能発現を調節し,個体としての恒常性を維持しています.このような生体内で細胞間相互に働く生理活性物質の中には医薬品として有用なものが多いのですが,生体内でもきわめて微量にしか存在しないため,これらを大量に入手するには大きな制約がありました.ところが,1970年代以降,目的のタンパク質をコードする遺伝子を大腸菌などの微生物に組込み発現させる組換えDNA技術により,生理活性タンパク質を大量に得ることが可能となりました.しかしながら,糖鎖や脂肪酸の付加,リン酸化などの修飾を受けるタンパク質や複雑なサブユニット構造をもつ高分子量のタンパク質の場合,微生物を用いて生産すると,動物が産生する天然型のものとは必ずしも同じにならないため,生体内で十分な生理活性や安定性が得られないことがわかってきました.このような生理活性タンパク質を生産するためには,動物などの細胞を用いざるを得ず,細胞培養技術は現在有用生理活性物質の生産手段として確固とした地位を築いています (表1).最近では,HER2過剰発現の転移性乳がんの治療薬としてヒト化モノクローナル抗体が厚生労働省から認可されるなど,次世代の大型バイオ医薬である治療用ヒト抗体医薬の実用化の時代が到来し,有用物質を効率よく生産可能な細胞培養技術の確立が求められています.
表1 動物細胞培養により生産される主な有用物質
|
物 質 |
機 能 |
|
ウイルスワクチン インターフェロン ティシュープラスミノーゲンアクチベーター エリスロポエチン コロニー刺激因子 モノクローナル抗体 |
感染症の予防 抗ウイルス作用,免疫調節作用 血栓溶解作用 赤血球の産生刺激 血液細胞の増殖・分化誘導 治療薬,臨床診断 |
細胞培養は,実験室では通常,プラスチック製のシャーレやフラスコなどの容器内で種々の栄養分を含んだ培養液 (培地) を用いて行われます.しかしながら,このような方法では有用物質を大量に生産することはできません.細胞培養により有用物質を大量に生産するためには,無血清培養技術および高密度大量培養技術の開発が不可欠となります.細胞培養用の培地は,無機塩類,糖類,アミノ酸,ビタミンなどを含んだ基本合成培地に,通常,生体外での細胞の生育・増殖を促進するために牛胎児などの血清が5–20%の濃度で添加されています.しかしながら,血清の添加により,コストが高くなる,目的タンパク質の分離精製が困難となる,生体由来の病原性物質の混入の危険性がある,などの問題が生じます.このため,血清のかわりにホルモン,成長因子などの種々のタンパク質を添加した無血清培地の開発が進められてきました.無血清培地の場合も,目的タンパク質の分離精製などを考慮すると,タンパク質の添加量を可能な限り少なくすることが望まれます.我々は,細胞膜を構成する主要な脂質であるリン脂質のうち,リゾホスファチジン酸 (LPA) やホスファチジン酸 (PA) を無血清培地に添加して,有用物質生産のための遺伝子組換えの宿主として広く利用されているChinese hamster ovary (CHO) 細胞の培養を行うと,細胞の増殖が促進されるだけではなく,組換えタンパク質の生産量も増大することを見出しました (図1).これらのリン脂質を無血清培地の構成成分として活用することにより,タンパク質含量の少ない無血清培地が開発できると期待されます.
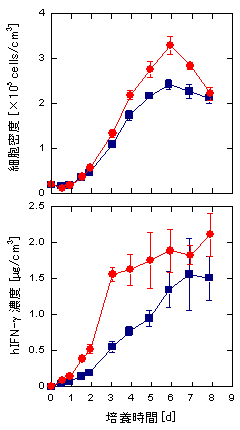
図1 無血清培養下における組換えCHO細胞の
増殖とヒトインターフェロン-g (hIFN-g) の生産に
及ぼすホスファチジン酸 (PA) の効果
■, PA無添加 ●, 10 mg/l PA添加
3.昆虫細胞を用いたタンパク質の生産
次に,昆虫の細胞とそれに感染するウイルスを利用したユニークな有用物質生産法について紹介しましょう.昆虫に特異的に感染するウイルスであるバキュロウイルスの一種,核多角体病ウイルス (NPV) は,感染した昆虫細胞の核内に多角体とよばれるウイルスを包埋保護するための封入体を形成します (図2左).この多角体の主要構成物質はポリヘドリンとよばれるタンパク質ですが,この遺伝子の発現を調節するプロモーターとよばれるDNA領域は非常に強力であるため,驚くべきことにウイルス感染後期には感染した細胞の全タンパク質の数十% をポリヘドリンが占めるようになります.ポリヘドリンは自然界でウイルスを保護するためには不可欠ですが,ウイルスの感染や増殖そのものには必要ではありません.このため,ポリヘドリン遺伝子のかわりに目的のタンパク質をコードした遺伝子を挿入した組換えウイルスを作製し (図2中),これを人工的な環境下で培養している昆虫細胞に感染させると,ポリヘドリンのかわりに目的タンパク質を大量に生産することができます (図2右).バキュロウイルスは動物や植物には感染しないため,安全であるうえに,生物学的活性や高次構造が本来のものと同様の組換えタンパク質を大量に生産可能であるため,昆虫細胞−バキュロウイルス系は,種々の機能性タンパク質を得るためのきわめて有効な手段として実験室レベルでは広く利用されています.

図2 昆虫細胞−バキュロウイルス系による組換えタンパク質の生産
プロテインキナーゼ (PKC) は,細胞内のさまざまな情報の伝達に関わる重要な酵素です.ラットのPKC-d の遺伝子を導入した組換え核多角体病ウイルスをSpodoptera frugiperda由来の昆虫細胞Sf9に感染させ,3日間培養した後の細胞抽出液を,SDS-ポリアクリルアミドゲル電気泳動 (SDS-PAGE) およびウェスタンブロット法という方法で分析しました (図3).SDS-PAGEでは,ポリアクリルアミドのゲル中で電気泳動を行うことによりタンパク質を大きさに応じて分離することができます.野生型のウイルスを感染させた場合,分子量31,000 (31 kDa) 付近に太いバンドがみられ,ポリヘドリンが非常に大量に発現していることがわかります (図3a,Lane 2).これに対し,組換えウイルスを感染させた場合,ポリヘドリンのかわりにPKC-d の分子量である77 kDa付近に太いバンドが認められます (図3a,Lane 3).ウェスタンブロット法では,電気泳動により分離したタンパク質を膜に転写し,目的のタンパク質と特異的に結合する抗体によって検出する方法です.PKC-d の一部と特異的に結合する抗体を用いると,組換えウイルスを感染させた細胞の場合にのみ分子量77 kDa付近に特異的なバンドが検出されました (図3b,Lane 3).これらの結果から,組換えバキュロウイルスを感染させた昆虫細胞によりPKC-d を大量に生産可能であることがわかります.

図3 昆虫細胞−バキュロウイルス系によるPKC-dの生産
(a) SDS-PAGE (b) ウェスタンブロット法
Lane 1:ウイルス未感染細胞の抽出液
Lane 2:野生型ウイルス感染細胞の抽出液
Lane 3:組換えウイルス感染細胞の抽出液
4.固定化法を用いた高密度培養技術
細胞培養により有用物質を大量に生産するためには,単位体積あたりの細胞数,すなわち細胞密度が高いほうが有利であると考えられます.しかしながら,動物や昆虫の細胞をフラスコやシャーレ内で培養すると,細胞は通常106 cells/cm3程度の密度で飽和に達してしまいます.これは,培養液中に占める細胞の体積で考えると0.1% 程度でしかなく,非常に低い値であることがわかります.このような高密度化を妨げる要因としては,培地中の栄養分や酸素の不足と自らが産生した乳酸やアンモニアなどの有害代謝産物の蓄積が挙げられます.また,昆虫細胞を高密度にまで増殖させた後に組換えウイルスを感染させると,低密度でウイルス感染を行った場合に比べて,細胞1個あたりの組換えタンパク質の生産量が低下することが知られています.この原因も,主として培地中の栄養分の枯渇であると考えられています.このような培地中の栄養分の不足や有害代謝産物の蓄積を回避するためには,細胞を培養系内に保持したまま古い培地を除去し,新しい培地を供給してやればよいと考えられます.このためには細胞と培地の分離操作が必要となりますが,小さくて脆弱な細胞を培地と効率良く分離するのは困難な作業となります.細胞や酵素などを何らかの手段により限定された空間内に集積し保持する操作を「固定化」といいます.動物や昆虫の細胞を適切な担体内に固定化して培養できると,細胞と培地を簡単にかつ効率良く分離できるだけでなく,物理的に脆弱な細胞を保護することが可能となります.また,培地や酸素の供給速度を増大できることなどから,有用物質の生産性を飛躍的に向上させることができると期待されます.
細胞の固定化法としては,高分子のゲル内に細胞を包括する方法や半透膜のカプセル内に細胞を封入する方法のように,細胞を人為的に担体内に固定化する方法が開発されています.これに対し,我々は,Biomass Support Particles (BSPs) とよばれる多孔性の粒子とともに細胞を培養することにより,細胞が有する付着力や凝集力によってその増殖過程において細胞が自然に粒子内に高密度で固定化される方法を開発してきました.この固定化法は,固定化の操作や無菌操作が簡単である,固定化担体が物理的に強固である,などの特長を持ち,工業的規模での利用に適した方法であると考えられます.そこで,本固定化法の昆虫細胞培養への応用を検討しました.
まず,種々の孔径を有するポリビニルホルマール (PVF) 樹脂多孔質体のスポンジシート (アイオン (株)) を細切して2×2×2 mmの粒子を作製し,昆虫細胞Sf9を懸濁した培地とともに振とうしながら培養を行いました.その結果,平均孔径が60 mmの粒子を用いた場合に,最も高い固定化生細胞密度が得られることがわかりました.定期的に培地交換しながら培養を継続すると,固定化細胞は多孔質体粒子1 cm3あたり5×107 cells以上にまで増殖しますが,これは通常の振とう培養で得られる細胞密度の10倍以上の高密度です.このことから,比較的孔径の小さい多孔性粒子を用いることにより昆虫細胞を高密度で固定化できることがわかりました (図4).

図4 ポリビニルホルマール (PVF) 樹脂多孔質体粒子
に固定化された昆虫細胞Sf9
次に,固定化細胞に組換えバキュロウイルスを感染させ,b–ガラクトシダーゼという酵素を生産させました.初期の固定化細胞密度が約2×107 cells/cm3-BSPの場合,ウイルス添加時に培地を新鮮培地に交換してから培養を行うと,固定化細胞1個あたりのb–ガラクトシダーゼの生産量は,固定化していない細胞とほぼ同等の高いレベルを示しました.これに比べて,初期固定化細胞密度が4–5×107 cells/cm3-BSPと高くなると,培養途中で培地交換を行わなかった場合や4日ごとに培地交換を行った場合,b–ガラクトシダーゼの生産量は低いレベルにとどまりました (図5).これは培地中の栄養分の枯渇が原因であると考えられますが,実際,2日ごとに培地交換しながら培養すると,4日ごとに培地交換を行った場合や培地交換を行わなかった場合に比べて,約2倍のb–ガラクトシダーゼが生産されることがわかりました.したがって,栄養分の枯渇が起こらないよう適切に培地交換を行うことによって,高密度培養下においても高い生産性を保持したタンパク質生産が可能であることが示唆されます.
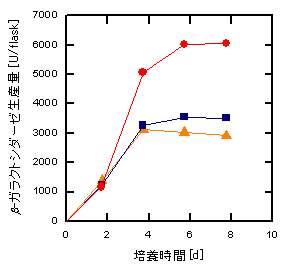
図5 固定化昆虫細胞によるb-ガラクトシダーゼ生産に及ぼす
培地交換頻度の影響
初期細胞密度:4–5×107 cells/cm3-BSP
培地量:15 ml BSPs:250個 (2 cm3)
培地交換頻度:●, 2日ごと;■, 4日ごと;▲, 培地交換なし
5.おわりに
細胞培養による有用物質生産に関して,我々が開発してきた無血清培養技術や高密度培養技術を紹介しました.近年の細胞培養技術の進歩は著しいものですが,まだまだ細胞の本来持っている機能が十分に発現されているとは言えません.今後は,生体外における細胞機能の制御技術をさらに進展させることにより,細胞の潜在能力を十分に発現できる高機能性バイオリアクターを開発したいと考えています.
6.参考文献
1) Hayashi, C.,
2) Yamaji, H., Hirakawa, D., Tagai, S., and Fukuda, H.: Production of protein kinase C-d by the baculovirus–insect cell system in serum-supplemented and serum-free media, J. Biosci. Bioeng., 95(2), 185–187 (2003)
3) 山地秀樹:昆虫細胞の高密度培養とタンパク質生産,バイオサイエンスとインダストリー,61(2), 99–102 (2003)
4)
5)
6) Yamaji, H., Tagai,
S.,
7)
8) Yamaji, H., Tagai,
S.,
9) 山地秀樹:多孔性粒子を用いる細胞の固定化,化学工学,63(12), 682–683 (1999)